本文转自奇点肿瘤探秘
胃癌的发病率和死亡率在全球范围内均位居前列,在亚洲、东欧等地区则更高[1]。
造成这一现象的一大因素就是,胃癌在患者之间存在着高度的组织学、转录组学以及基因组学差异,这导致患者的临床表现以及对治疗的应答程度并不一致。
除此之外,患者体内肿瘤细胞之间的异质性,也影响着肿瘤的发展和治疗的效果。然而,科学家们对胃癌的异质性特征,还缺乏较为全面的理解。
近日,由杜克-新加坡国立大学医学院的Patrick Tan教授领衔的研究团队,在《癌症发现》期刊发表重要研究成果。
他们利用来自31例不同临床分期和组织学亚型的胃癌患者的48个样本,产生了包含超过200000个胃癌细胞的单细胞图谱,为胃癌的肿瘤内和肿瘤间的细胞谱系研究,提供了高分辨率的分子数据资源[2]。

论文截图
在胃癌患者的临床治疗中,考虑胃癌的异质性并能识别驱动异质性的分子通路,被认为是能改善患者预后的措施,也是众多研究者们的目标。
一些基于TCGA和ACRG数据的研究也证实了这一点,但它们大都关注于胃癌患者间的异质性(inter-patient heterogeneity),而越来越多的科学家认为胃癌患者还有着高度的体内癌细胞间的异质性(intra-patient heterogeneity, ITH)[3,4]。
因此,需要有关于胃癌患者高分辨率的数据,来研究胃癌细胞在体内如何进化、选择和适应,以及指导临床治疗方案。
尽管一些分解算法能从传统的bulk RNA-seq中分解出单个细胞系表达谱,并且有研究借此发现了胃癌的异质性是由癌上皮细胞和微环境中其他细胞共同作用造成的[5]。但这种方法无法发现一些小规模细胞亚群,以及细胞间互作关系。
考虑到这些局限性,Patrick Tan团队采用了单细胞测序手段。
他们对来自31个有着不同的临床分期、组织学特征、分子亚型的胃癌患者的48个肿瘤和相应的正常胃部样本进行了单细胞测序,包含的细胞数量超过200000个。同时,为了研究体外培养对肿瘤及其微环境的影响,他们还对患者的体外肿瘤类器官进行了单细胞测序。
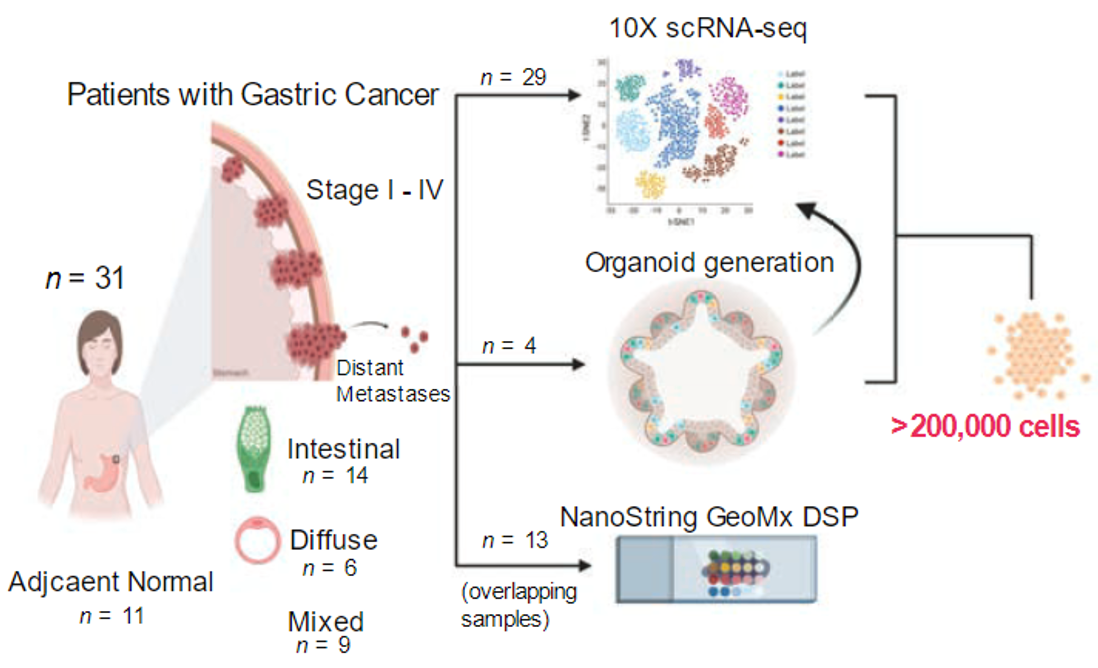
样本概览
对scRNA-seq数据的降维聚类分析发现了34种细胞类型,根据已报道的组织特异的标志物,又可以分为5大类,这在后续的非监督聚类中得到进一步验证。
在所有细胞中,淋巴细胞不论是种类还是数量的都是最多的。
得益于所测序的细胞数量较多,他们还发现了一些新的罕见细胞类型STF4,它同时表达内皮细胞以及成纤维细胞相关的标志基因。
接着,通过比较原发性的胃癌样本和相应的正常组织样本的单细胞表达谱,Patrick Tan团队发现:在肿瘤中,上皮细胞比例小于正常组织,而髓样细胞比例要大于正常组织。
不仅如此,相比于正常组织,肿瘤中上皮细胞会表达更高水平的与上皮-间质转化,以及细胞运动能力相关的癌基因。
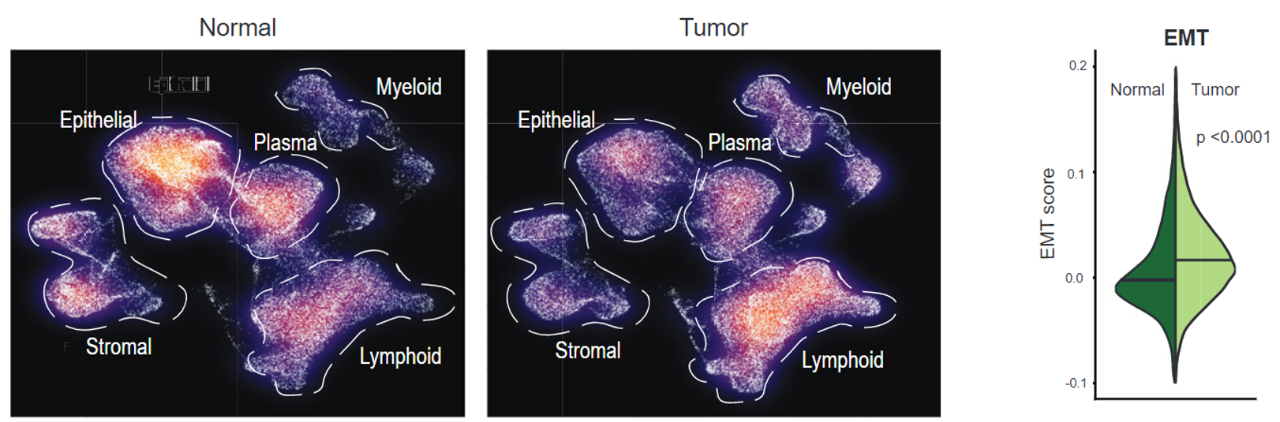
肿瘤和正常组织在细胞比例上的比较(左);肿瘤中EMT相关基因表达量增加(右)
但前面的分析发现胃癌组织中有多种上皮细胞,为了确定哪一种上皮细胞为主要细胞(chief cell),研究人员比较了不同上皮细胞中一些胃癌相关癌基因的表达量,发现Epilnt1表现出上述基因的显著上调。此外,与正常组织的上皮细胞相比,Epilnt1也有更多的拷贝数变异。
包含所有基因的分析发现,肿瘤各种类型上皮细胞上调和下调的基因数量存在差异,进一步表明了肿瘤内异质性。
在基质细胞中,研究人员发现成纤维细胞的三种亚型在一些CAF基因上存在表达调控的差异。
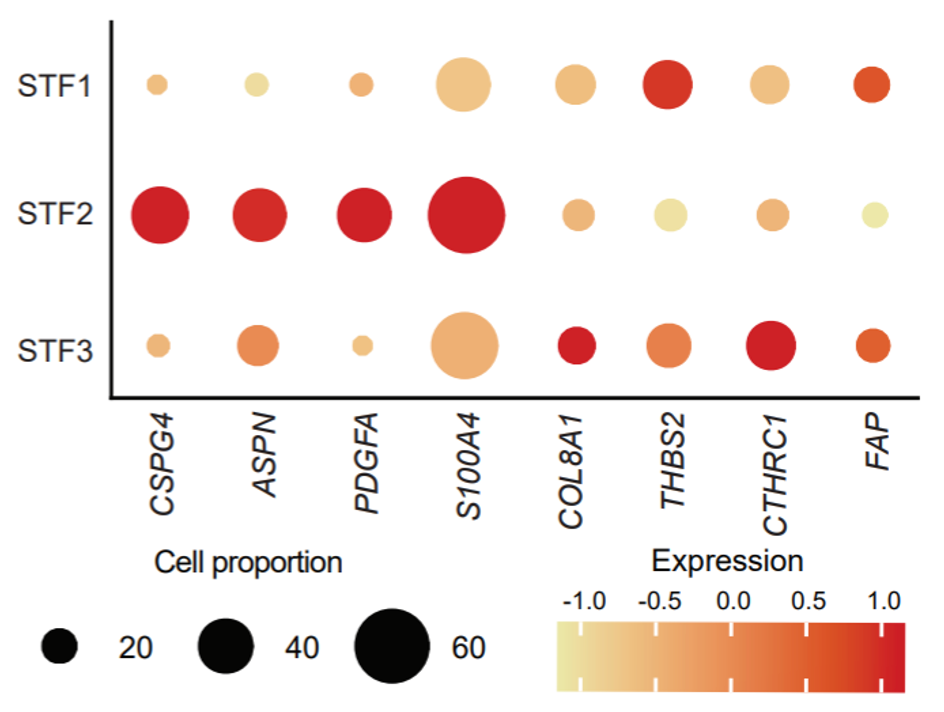
成纤维细胞在CAF基因上有表达调控差异
他们还比较了肿瘤和正常组织中的T细胞比例,结果与之前的报道一致——肿瘤组织中的T细胞比例更大。并且TCR在胃癌中表达的异质性与其他类型肿瘤类似。
这些结果表明,在胃癌组织中来自上皮和微环境中的细胞会表达不同的癌基因,形成了肿瘤复杂的分子肖像,从而促进肿瘤的发生发展。
临床上根据Lauren分型可将胃癌分为弥漫型和肠型,这两种类型的胃癌在组织结构和生物行为上均存在差异,为了探究其背后的分子机制差异,研究人员利用他们测出来的这两种类型胃癌的单细胞数据进行了分析。
在弥漫型和肠型胃癌的单细胞数据比较中,研究人员发现弥漫型胃癌的浆细胞比例更大而上皮细胞的比例更小。此前曾有研究报道在多发性骨髓瘤中KLF2调控浆细胞的归巢,因此Patrick Tan团队猜测:弥漫型胃癌中出现更大比例的浆细胞可能是受到KLF2的调控[6]。
为了验证猜想,他们将肠型胃癌和弥漫型胃癌中浆细胞和上皮细胞的KLF2的表达量进行了比较,发现弥漫型胃癌中超过50%的细胞出现KLF2上调,并且浆细胞的比例与上皮细胞中的KLF2表达量有关,而与浆细胞中的KLF2表达量无关。
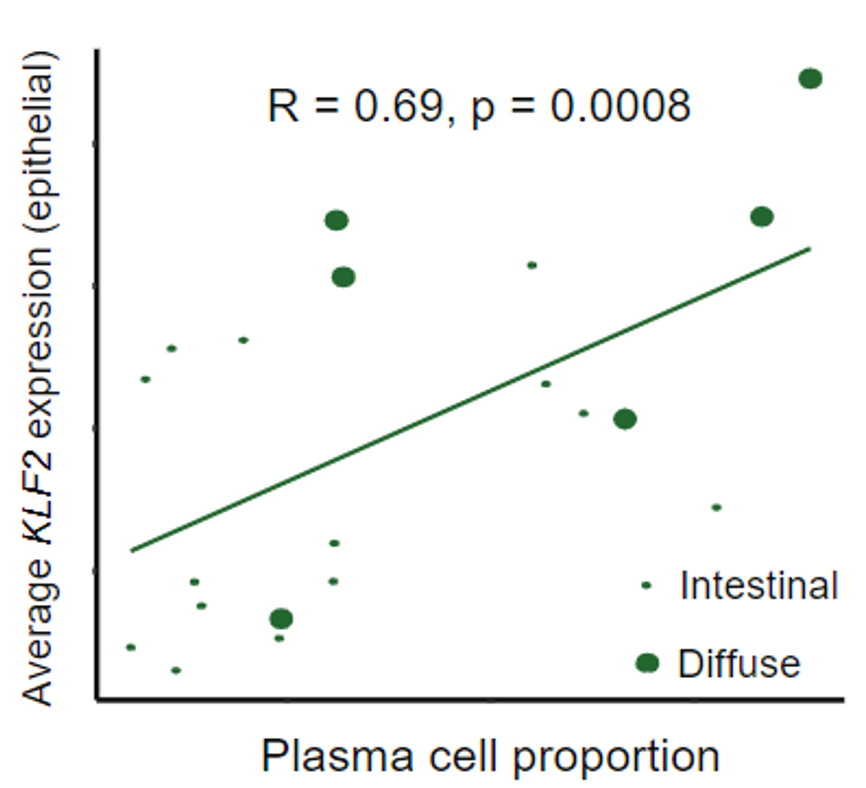
弥漫型胃癌中浆细胞的比例和上皮细胞的KLF2表达量有关
他们认为上皮细胞的KLF2表达可能与浆细胞的募集有关,在后续的空间转录组测序,以及小鼠实验中也验证了这一点。
肿瘤相关成纤维细胞(CAF)在肿瘤的生长、转移、入侵中发挥重要作用,为了研究CAF在胃癌中的调控通路以及异质性,研究人员利用scRNA-seq数据比较了不同临床分期和组织学亚型的肿瘤样本中三种成纤维细胞(STF1-3)的比例,发现随着肿瘤进入晚期,成纤维细胞的比例逐渐变大。
TGF-在其他癌症中被报道能影响CAF的功能,那么在胃癌中是否有同样的功能呢[7]?
研究人员首先分析了TGF-通路所包含的9个基因,在胃癌三种成纤维细胞中的表达情况,发现与正常组织相比,只有INHBA在STF2和STF3中出现上调。
随后,通过INHBA与CAF的经典标志基因的共表达分析,研究人员发现INHBA在STF3中与FAP有着显著的正相关关系。像之前一样,他们也做了空间转录组分析来验证。
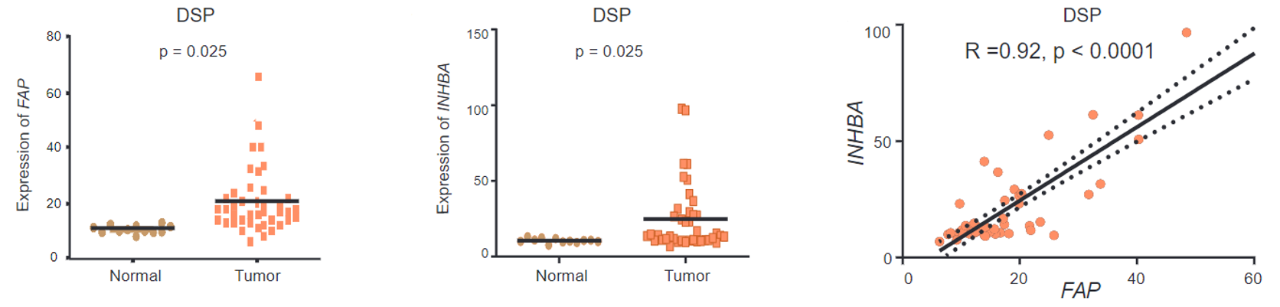
FAP和INHBA在正常组织和胃癌组织中的表达差异(左、中);
在胃癌组织中FAP和INHBA表达的相关性
除此之外,Patrick Tan团队还评估了FAP和INHBA的共表达在临床上的作用,他们发现随着胃癌进入晚期,STF3中表达INHBA和FAP的细胞就会越多,并且INHBA的表达量越高,患者的生存期越短。
和前面的结论串起来就是随着癌症进入晚期,STF3的比例增加,表达INHBA和FAP的细胞数量也会增加,并且患者的生存期变短。
最后,研究人员探究了与体内肿瘤细胞相比,体外肿瘤类器官培养对细胞转录状态和整体的细胞比例的影响程度。
他们对肿瘤类器官的scRNA-seq数据做了一样的降维聚类分析,发现尽管在各种细胞比例上和体内肿瘤有一些差异,但是仍然存在内部细胞异质性,以及在一些胃癌相关的基因上与体内肿瘤有着相同的调控趋势。
值得一提的是,在类器官模型的细胞轨迹分析中,肿瘤组织的上皮细胞有着更多的轨迹分支,这与之前的一项研究的结论一致——肿瘤相关的上皮细胞有着更大的转录可塑性,这也可能是造成肿瘤内异质性的关键因素[8]。
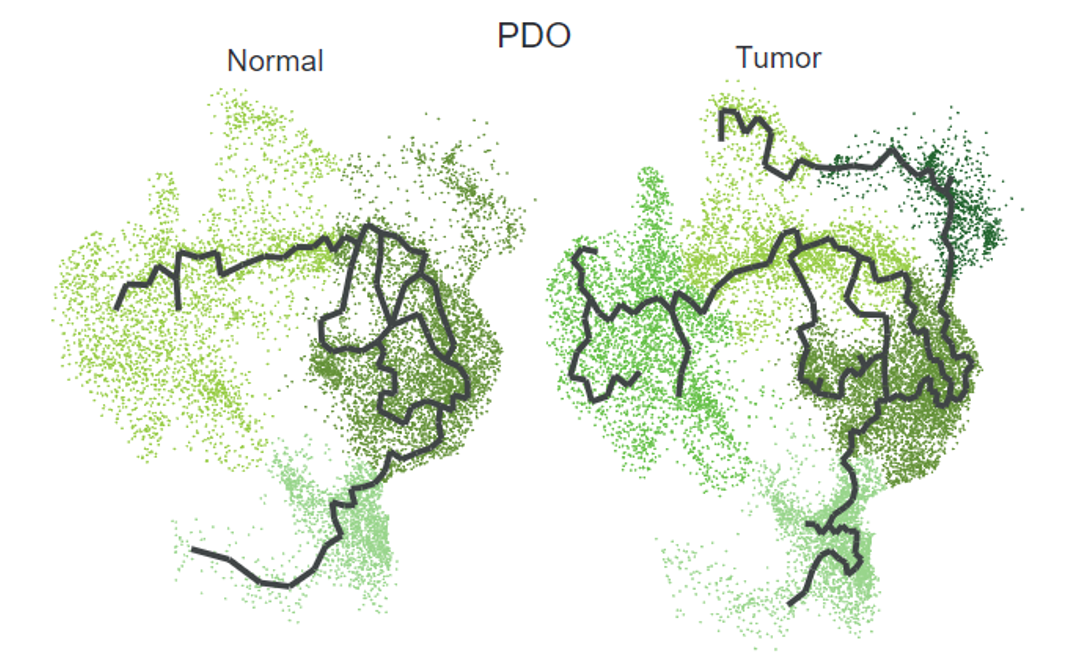
肿瘤类器官模型的上皮细胞轨迹分析
总的来说,这项研究利用单细胞测序技术对超过20万个涵盖不同临床分期和组织学亚型的胃癌细胞,以及正常组织细胞进行测序,产生了较为全面的综合性数据,也因此发现了胃癌的一些新特征。
此外,Patrick Tan团队还利用空间转录组技术进行验证,保证了结论的可靠性,这在以往的研究中是不曾有的。
作为迄今为止胃癌最大规模的单细胞数据分析之一,该研究为未来该领域的研究提供了关于肿瘤细胞类型差异以及细胞互作的全新生物学见解。
参考文献:
[1] Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. doi:10.3322/caac.21492
[2] Kumar V, Ramnarayanan K, Sundar R, et al. Single-cell atlas of lineage states, tumor microenvironment and subtype-specific expression programs in gastric cancer. Cancer Discov. 2021;candisc.0683.2021. doi:10.1158/2159-8290.CD-21-0683
[3] Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513(7517):202-209. doi:10.1038/nature13480
[4] Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med. 2015;21(5):449-456. doi:10.1038/nm.3850
[5] Newman AM, Steen CB, Liu CL, et al. Determining cell type abundance and expression from bulk tissues with digital cytometry. Nat Biotechnol. 2019;37(7):773-782. doi:10.1038/s41587-019-0114-2
[6] Ohguchi H, Hideshima T, Bhasin MK, et al. The KDM3A-KLF2-IRF4 axis maintains myeloma cell survival. Nat Commun. 2016;7:10258. Published 2016 Jan 5. doi:10.1038/ncomms10258
[7] Calon A, Tauriello DV, Batlle E. TGF-beta in CAF-mediated tumor growth and metastasis. Semin Cancer Biol. 2014;25:15-22. doi:10.1016/j.semcancer.2013.12.008
[8] Wang R, Dang M, Harada K, et al. Single-cell dissection of intratumoral heterogeneity and lineage diversity in metastatic gastric adenocarcinoma. Nat Med. 2021;27(1):141-151. doi:10.1038/s41591-020-1125-8
原文网址:https://mp.weixin.qq.com/s/Biz03Tda3x1TNGDZFBYNVw
日本医学顾问会在30分钟之内给您回复
服务时间(9:00-18:00)